Dans cette partie, nous allons aborder les bulles sphériques; ces bulles paraissent extrêmement simples mais en réalité plusieurs facteurs environnementaux et physiques sont primordiaux dans la formation d’une bulle sphérique de savon. Nous allons les étudier et vous les présenter en plusieurs parties.
1) Composition d'une bulle de savon
Nous pouvons définir une bulle de savon comme une sphère parfaite, lisse et peu déformable. Elle est constituée d’une fine couche d’eau savonneuse rempli d’air, flottant dans l’atmosphère. La surface d'une bulle est comme une membrane tendue, caractérisée par une tension superficielle qui empêche sa déformation.
(Par définition, c’est une fine membrane de liquide entourant de l’air. Sa formation nécessite la présence de tensioactifs pour pouvoir étirer la surface.)
Les molécules de savon, comme nous l'avions vu auparavant, sont composées d'une tête hydrophile qui aime l'eau et qui est chargée négativement et d'une queue hydrophobe qui n'aime pas l'eau et qui est chargée positivement. L'eau possède également des charges partielles, ce qui explique que les têtes des molécules de savon et les molécules d'eau (H2O) ont des affinité, contrairement à la queue d'une molécule de savon qui n'est pas chargée du tout et n'a donc aucune affinité avec l'eau.

2) Tensioactifs.
Comme nous l'avons vu auparavant à plusieurs reprises, les tensioactifs sont des éléments importants dans une bulle de savon.
Rappel : Un tensioactif est une substance modifiant la tension superficielle entre deux surfaces.
Rappel : Un tensioactif est une substance modifiant la tension superficielle entre deux surfaces.
Un tensioactif est composé de 2 parties :
-Une partie qui s'accroche à l'eau : la partie hydrophile, c'est-à-dire qui aime l'eau (ou encore lipophobe). C’est la tête de la molécule qui est dite polaire.
-Une partie qui s'accroche à la graisse : la partie hydrophobe c'est-à-dire qui n'aime pas l'eau. Cette partie-là est une chaîne carbonée de dix à vingt atomes de carbone, qui est donc apolaire.

Pour montrer explicitement cela, nous avons fait une expérience extrêmement simple au labo :
► Nous avons dans un premier cas mélangé de l'eau et de l’huile. Sans surprise l'eau et l'huile ne se mélangent pas, car la queue de la molécule d'huile n'aime pas l'eau, et donc ne peut pas se mélanger avec l'eau.
► Or, lorsque l'on mélange du sirop et de l'eau, le mélange devient complètement homogène car dans la molécule de sirop, il n'y a pas de partie hydrophobe.
3) La tension superficielle
La tension de surface (ou superficielle) est une force qui existe au niveau de toute interface entre deux milieux différents (liquide/liquide ou liquide/gaz...). En effet, le système tend à minimiser la surface de contact entre les deux milieux. Cette force s’exerce sur un liquide (dans notre cas l’eau) qui l’incite à diminuer sa surface de contact avec l’air et à avoir davantage d’affinités avec lui-même. Il y a effectivement une différence d'énergie entre deux milieux (appelée énergie de surface)
En effet dans un liquide, les molécules exercent entre elles des forces d'attraction ou de répulsion. Le cohésion entre les molécules proviennent d’interactions électrostatiques, appelées interactions de van der Waals. Chaque molécule attire les molécules autour d'elle et cette même molécule subit l'attirance des autres molécules. C'est avec ce principe que l'on explique la cohésion des solides moléculaires.
Or pour les molécules d'eau situées en contact de l'air, elles ne vont pas créer d'attraction avec les molécules d'air. C'est pour cela que leurs forces vont se tournées vers l'intérieur du liquide : 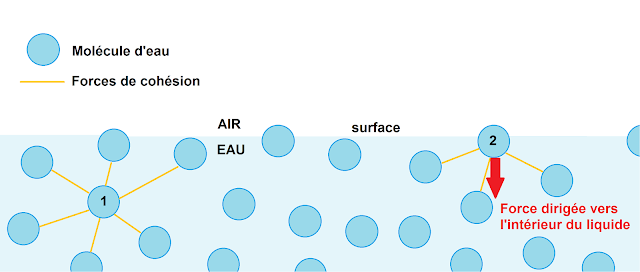
C'est ces forces "tournées vers l'intérieur du liquide" qui créent cette tension de surface.
Pour bien comprendre cette tension, prenons le cas d'une expérience très simple. Avez-vous déjà vu un trombone flotter sur l'eau, comme ici ? : 
Cela semble surprenant car on sait que le trombone a une densité plus élevée que celle de l'eau et devrait donc couler. Or il ne coule grâce grâce à cette tension de surface.
En revanche, si l'on rajoute du savon dans cette eau, la trombone va couler car, comme nous l'avions vu auparavant, le savon diminue la tension de surface.
4) La loi de Laplace
Nous savons que deux milieux non miscibles sont séparés par une interface. Dès que cette interface est courbée, il y a une différence de pression entre les deux milieux. Ainsi, la pression est plus grande dans une goutte de pluie ou dans une bulle de savon que dans l'atmosphère qui l'entoure. Cette différence de pression dépend essentiellement de la tension de surface (= superficielle), qui mesure l'énergie nécessaire à la création d'une interface.

La bulle est soumise à deux pressions :
● la pression intérieure qui a pour but d'étirer la membrane de la bulle
● la pression extérieure qui contracte la bulle sur elle-même.
La loi de Laplace est à l'origine de la forme parfaitement ronde d'une bulle de savon. En effet la pression est uniforme. Pour calculer cette pression il ne faut pas oublier que au sein d'une bulle, on retrouve deux interfaces : air/liquide et liquide/air. La différence de pression entre l'intérieur et l’extérieur de la bulle est donc doublée. On obtient l'égalité suivante :

→ P1 est la pression atmosphérique en pascals ;
→ P2 est la pression dans la bulle en pascals ;
→ Ɣ est la tension superficielle en newtons par mètre ;
→ R est le rayon de la bulle en mètre.
→ Grâce à cette partie, nous avons mieux compris qu'est ce qu'était une bulle, de quoi est-elle faite; etc...
Mais nous allons ensuite parler dans la partie suivante du plus important de notre TPE : les bulles cubiques.
↓
→ Grâce à cette partie, nous avons mieux compris qu'est ce qu'était une bulle, de quoi est-elle faite; etc...
Mais nous allons ensuite parler dans la partie suivante du plus important de notre TPE : les bulles cubiques.
↓





